周更专栏 | 线粒体医学,兴奋效应,抗衰老医学
结论
线粒体功能障碍是多种人类疾病所固有的,从由线粒体DNA突变引起的经典线粒体疾病(脑肌病)到涉及细胞器其余部分的线粒体信号传导途径的疾病,受细胞器动力学调节并最终导致程序性细胞死亡。从衰老形成的自由基学说,到氧化应激学说,再到线粒体学说,无不提示衰老和线粒体紧密关系。健康生活方式激活的神经信号通路,例如适度的体育锻炼、热量限制、间歇性禁食、热休克反应和抗氧化剂多酚等都可以刺激大脑神经元中的线粒体生物发生,从而促进调节人类衰老和寿命的神经可塑性和毒物兴奋恢复途径。
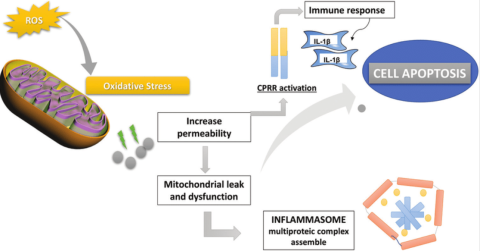
衰老的线粒体学说
在本章作者看来,在众多抗衰老机制学说中,线粒体学说和氧化应激学说是两大最可靠并被科学界广泛接受的。在真核细胞中,线粒体负责产生ATP。线粒体DNA,也叫mtDNA,与细胞核DNA(nDNA)一样,经常暴露于破坏性物质中。多年来,人们一直认为过度受损的mtDNA分子会被降解,并被未受损基因组复制的新生成的后继分子所取代。然而,研究结果表明线粒体拥有修复内源性或外源性有害物质引起的基因组损伤所需的机制。研究发现自由基参与衰老过程,线粒体衍生的ROS(reactive oxygen species,活性氧自由基)可能影响细胞衰老[1]。用线粒体电子传递链(N‑叔丁基羟胺)回收的抗氧化剂处理 IMR‑90成纤维细胞,最初支持了线粒体参与细胞衰老的理论。N‑叔丁基羟胺通过减少 ROS 产生、保留线粒体膜电位和增加细胞活性,延长成纤维细胞复制能力并延迟因年龄而导致的线粒体功能变化。
由于其较高的致突变倾向,mtDNA在生命过程中的积累被认为是与年龄相关疾病的主要原因。缺乏内含子、保护性组蛋白和DNA修复机制,以及暴露于富含自由基的环境,都是导致mtDNA突变率比核DNA(nDNA)高10倍的因素。多项研究表明,mtDNA突变随着年龄的增长而增加,在大脑和肌肉中表达最高。第一份关于mtDNA缺失与年龄相关的增加的报告是在老年人大脑和帕金森病中发现的[2]。
污染、辐射、环境压力等外部因素以及吸烟、饮酒、不健康食品、缺乏运动、肥胖等不健康的习惯都会导致活性氧产生增加和其他衰老的负面影响。另一方面,细胞防御机制,如ROS清除酶、维生素、类黄酮和类胡萝卜素等抗氧化剂,可以减少ROS的产生,保护我们的端粒,减少线粒体损伤,延长我们的健康寿命。积极的生活习惯,例如定期适度运动、放松和健康饮食,同样可以改善我们的衰老状况。
衰老的氧化应激学说
衰老的自由基理论,后来被称为衰老的氧化应激学说,建立在基于结构损伤的假设之上,即与年龄相关的功能丧失是由于ROS对大分子(脂质、DNA和蛋白质)氧化损伤的积累所致[3]。氧化应激诱导衰老的确切机制尚不清楚,但可能是活性氧水平增加导致细胞衰老,这是一种生理机制,可响应复制过程中发生的损伤而停止细胞增殖。
一种解释认为,细胞应激反应需要激活促生存途径,该途径在称为vitagenes的保护性基因控制下产生具有抗氧化和抗凋亡活性的分子(热休克蛋白、谷胱甘肽、胆红素)[4]。细胞应激反应在转录、翻译和翻译后水平上受到热休克转录因子(HSF) 家族的调节,这些转录因子在非应激条件下表达并维持在非活性状态。根据目前的知识,HSF1循环的衰减阶段受到双重机制的调节:依赖于通过与HSF1的弱相互作用直接反馈的HSP水平,以及涉及 SIRT1依赖的HSF1 DNA 结合活性控制的并行步骤。由于SIRT1与热量限制和衰老有关,因此SIRT1的年龄依赖性丧失和HSF1活性受损与衰老细胞的热休克反应和蛋白质稳态受损相关,将热休克反应与营养和衰老联系起来。
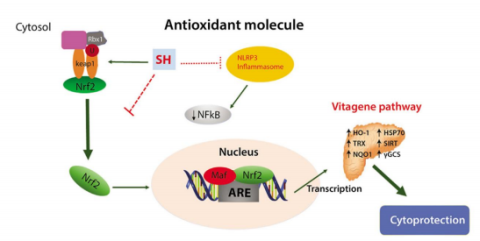
下图显示的是氧化还原状态对Nrf2‑vitagene途径的调节。Nrf2通常在胞质溶胶中与其抑制剂Keap1 结合,通过与基于 Cul3‑Rbx1 的E3/泛素连接酶复合物结合进行泛素化和蛋白酶体降解。在应激条件下,Nrf2从Keap1中释放并易位到胞核中,在胞核中DNA启动子区域中的Maf转录因子形成异二聚体结合,与ARE的2相结合。H2S抗氧化剂分子通过激活Nrf2核位和细胞保护性(第2相)vitagenes的转录来阻断氧化应激和NLRP3炎性因子级联。HO‑1、Hsp70、Trx、Sirt1、NQO1、γ‑GCS等vitagene通路上调可改善组织,特别是大脑健康。
兴奋效应(hormesis效应)
Hormesis效应,也称兴奋效应,在医疗范围最多的译为“毒物兴奋效应”。本词首次由Southam和Ehrlich于1943年在出版的文献中提出,他们发现,低剂量的红雪松树提取物可增强真菌的增殖,而高剂量低提取对此获益到达峰值后即出现下降,甚至还会抑制菌的增殖,这种“低促高依”的双相剂量反应,称为Hormesis效应(如下图)。
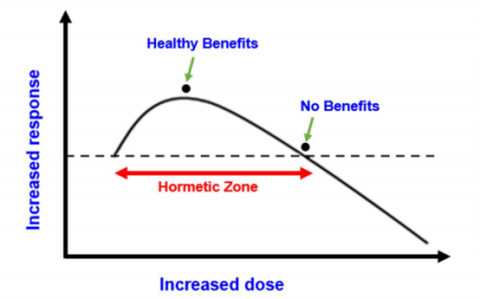
毒物兴奋效应的概念因其普遍性而成为逐渐成为生物医学的核心。支持这些类型的生物限制的数据非常广泛。例如,许多在高剂量下杀死肿瘤细胞的抗肿瘤药物也可能在较低剂量下刺激这些细胞的增殖,表现出毒物兴奋剂量反应[5]。与本文特别相关的是毒物兴奋效应概念可用于理解生物学极限,在该极限内进行的抗衰老药物,其初衷是增强衰老的质量并延长寿命。因为从毒物兴奋效应概念认为,在大多数情况下,所有生物系统的生物性能只能得到适度改善,继续增加剂量,之前的获益可能荡然无存,甚至产生负面毒性效应。
新涌现的成功老龄化理论
Bruno N. Ames新提出的老龄化理论,称为Triage Theory(分类学说)。分类学说表面,许多营养素,特别是维生素和蛋白质,对于生存和长寿发挥着双重作用。进化会选择确保当遇到维生素或矿物质短缺时,这些稀缺的资源会优先被用于对生存和繁殖至关重要的依赖性优先蛋白质/酶,例如早期发育和维持生存所必需的蛋白质。与此同时,预防损伤来维持长期健康所需的存活蛋白/酶就会缺乏,从而导致衰老疾病的增加[6]。
根据分类理论,维生素和必需矿物质是对生存或防止严重疾病至关重要的化合物,大多数对于关键的代谢功能是必需的,从饮食中去除它们已显示出巨大的短期影响。Ames引入了分类配给机制中的两个基本概念:长寿蛋白质和长寿维生素。长寿蛋白质是那些具有预防衰老疾病的特殊功能的蛋白。相比之下,那些短期生存和繁殖所需的酶/蛋白质,因为能优先提供其功能所需的维生素或矿物质,被称为生存酶/蛋白质。而长寿蛋白质发挥功能所需的膳食化合物属于一个特殊类别——长寿维生素,其短缺会导致累积性和潜在的损害。
长寿维生素可分为两大类:
(a)支持生存和长寿蛋白质,因此受到分类配给;
(b)支持健康,但不强调生存,但其短缺会导致加速衰老,这些物质可能会也可能无法配给,例如抗氧化剂。十种公认的长寿维生素包括:维生素D;胆碱;牛磺酸;麦角硫因(ergothioneine);吡咯喹啉醌(pyrroloquinoline quinone);喹啉(queuine);类胡萝卜素(carotenoids)等。显然,长寿蛋白功能的损害会导致与衰老相关的疾病风险的增加。所以,有利于长寿的的“健康食品”,除了考虑卡路里因素,还应有高含量的维生素和矿物质、膳食纤维和以及长寿蛋白质,例如坚果/种子、鸡蛋、海鲜、蔬菜和水果等等。
小结
老化的机制非常复杂,也是一项系统过程,不同个体的老化差距仍然是对从正常的健康老化到与疾病相关的病理性衰老的主动途径转变认识不足。作为正常健康老龄化的主要并发症,与年龄相关的氧化诱发疾病的风险增加,例如癌症、糖尿病、心血管和神经退行性疾病。以上这些会对生活质量产生不利影响,并伴随并发症和死亡率的发生率增加,应予以足够重视。
本文作者对本章谈及的两大抗衰老基本学说深表赞同,所引用的参考文献,也是经典的经典,这些也是我们日常抗衰老评估、干预的重点所在。今年三月有幸同成长博士一起直播分享,他本人在全年美国抗衰老医学科学院年会上的发言主题,也是关于氧化应激理论在新冠防治及抗衰老方面的心得体会。真是殊途同归,英雄所见略同!
原书本章中还详细探讨了毒物兴奋效应的详细阐述和抗压能力相关的生物机制,非常值得深入阅读。
参考文献:
[1] Harman., Aging: a theory based on free radical and radiation chemistry, J. Gerontol.11: 298–300, 1956.
[2] Calabrese V., Guagliano E., Sapienza M., Panebianco M., Calafato S., Puleo E., Pennisi G., Mancuso C., Butterfield D.A., Stella A.G. Redox regulation of cellular stress response in aging and neurodegenerative disorders: role of vitagenes, Neurochem. Res. 32: 757–773, 2007.
[3] Beckman KB., Ames BN. The free radical theory of aging matures. Physiol Rev. 78(2): 547–581, 1998.
[4] Mair, W., Dillin, A., 2008. Aging and survival: the genetics of life span extension by dietary restriction. Annu. Rev. Biochem. 77, 727–754.
[5] Calabrese, E.J., 2005c. Cancer biology and hormesis: human tumor cell lines commonly display hormetic (biphasic) dose responses. Crit. Rev. Toxicol. 35, 463–582.
[6] Ames BN. Prolonging healthy aging: Longevity vitamins and proteins. Proc Natl Acad Sci U S A. 2018 Oct 23; 115(43).
作 者
Vittorio Calabrese
意大利卡塔尼亚大学病理及临床学教授
解读作者
黄力文 Jason LW. Huang
中国抗衰老临床实践培训联合创始人
香港中文大学全科预防医学博士
美国抗衰老医学科学院(A4M)认证医师
《未完待续》
